Atom Bohr
Pada tahun 1913, fisikawan Denmark Niels Bohr mengoreksi kegagalan atom Rutherford melalui eksperimennya pada spektrum atom hidrogen. Eksperimen tersebut berhasil menguraikan keadaan elektronik yang menempati wilayah di sekitar nukleus. Interpretasi Bohr tentang atom hidrogen menggabungkan teori klasik Rutherford dan teori kuantum Planck, yang diwakili oleh lima asumsi, sebagai berikut:
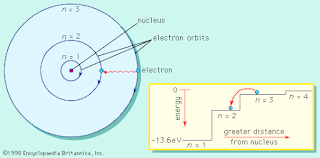
1. Elektron mengorbit inti dalam orbit melingkar tertentu. Orbital ini sering disebut sebagai kulit elektron dan dilambangkan dengan simbol K, L, M, N...dst, sesuai dengan n = 1, 2, 3, 4...dst.
2. Elektron pada setiap orbital memiliki energi tertentu, dan semakin besar lingkaran orbital atau semakin besar nilai n maka energinya semakin tinggi. Energi ini terkuantisasi dan nilai yang diijinkan diwakili oleh momentum sudut terkuantisasi elektron sebagai n (h/2π), di mana n = 1, 2, 3, 4...dst
3. Selama dalam orbitnya, elektron tidak memancarkan energi dan dikatakan dalam keadaan stasioner. Keberadaan elektron dalam orbit stasioner ini dipertahankan oleh gaya tarik elektrostatik elektron oleh inti atom yang diseimbangkan oleh gaya sentrifugal dari gerak elektron.
4. Elektron dapat berpindah dari orbit satu ke orbit lain yang mempunyai energi lebih tinggi bila elektron tersebut menyerap energi yang besarnya sesuai dengan perbedaan energi antara kedua orbit yang bersangkutan, dan sebaliknya bila elektron berpindah ke orbit yang mempunyai energi lebih rendah akan memancarkan energi radiasi yang teramati sebagai spektrum garis yang besarnya sesuai dengan perbedaan energi antara kedua orbit yang bersangkutan.
5. Atom dalam molekul dikatakan dalam keadaan tingkat dasar (ground state) apabila elektron-elektronnya menempati orbit-orbit sedemikian sehingga memberikan energi total terendah. Dan apabila elektron-elektron menempati orbit-orbit yang memberikan energi lebih tinggi daripada energi tingkat dasarnya dikatakan atom dalam tingkat tereksitasi (excited state). Atom dalam keadaan dasar lebih stabil daripada dalam keadaan tereksitasi.
Percobaan Atom Bohr
Menurut model atom Bohr, elektron mengorbit inti dalam orbit tertentu yang disebut kulit elektron atau tingkat energi. Tingkat energi terendah adalah kulit elektron terdalam, dan semakin jauh Anda pergi, semakin besar jumlah kulitnya, semakin tinggi tingkat energinya.
Kekuatan dan kelemahan Model Atom Bohr
Keuntungan Atom Bohr
Sebuah atom terdiri dari beberapa kulit/subkulit untuk mentransfer elektron, atom membentuk orbital yang nukleusnya positif dan ada elektron di sekitarnya.
Kelemahan Atom Bohr
1. Pelanggaran Prinsip Ketidakpastian Heisenberg, karena elektron telah mengetahui jari-jari dan lintasannya.
2. Model atom Bohr memiliki nilai yang salah untuk momentum sudut jalur keadaan dasar.
3. Lemahnya interpretasi prediksi untuk spektrum atom yang lebih besar.
4. Intensitas relatif dari garis spektral tidak dapat diprediksi.
5. Model atom Bohr tidak menjelaskan struktur garis spektrum dengan baik.
6. Zeeman yang tidak dapat dijelaskan dan efek orbital









0 Komentar